発光タグ HiBiT による タンパク質発現解析新時代の幕開け
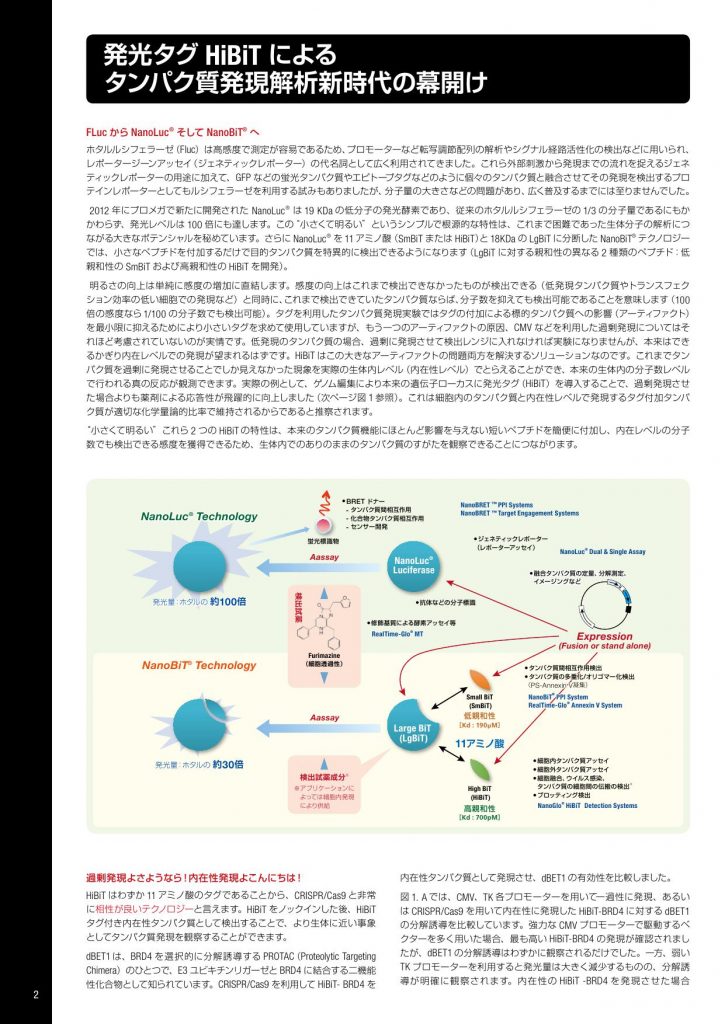
FLuc から NanoLuc® そして NanoBiT® へ ホタルルシフェラーゼ(Fluc)は高感度で測定が容易であるため、プロモーターなど転写調節配列の解析やシグナル経路活性化の検出などに用いられ、 レポータージーンアッセイ(ジェネティックレポーター)の代名詞として広く利用されてきました。これら外部刺激から発現までの流れを捉えるジェネ ティックレポーターの用途に加えて、GFP などの蛍光タンパク質やエピトープタグなどのように個々のタンパク質と融合させてその発現を検出するプロ テインレポーターとしてもルシフェラーゼを利用する試みもありましたが、分子量の大きさなどの問題があり、広く普及するまでには至りませんでした。 2012 年にプロメガで新たに開発された NanoLuc® は 19 KDa の低分子の発光酵素であり、従来のホタルルシフェラーゼの 1/3 の分子量であるにもか かわらず、発光レベルは 100 倍にも達します。この“小さくて明るい”というシンプルで根源的な特性は、これまで困難であった生体分子の解析につ ながる大きなポテンシャルを秘めています。さらに NanoLuc® を 11 アミノ酸(SmBiT または HiBiT)と 18KDa の LgBiT に分断した NanoBiT® テクノロジー では、小さなペプチドを付加するだけで目的タンパク質を特異的に検出できるようになります(LgBiT に対する親和性の異なる 2 種類のペプチド:低 親和性の SmBiT および高親和性の HiBiT を開発)。 明るさの向上は単純に感度の増加に直結します。感度の向上はこれまで検出できなかったものが検出できる(低発現タンパク質やトランスフェク ション効率の低い細胞での発現など)と同時に、これまで検出できていたタンパク質ならば、分子数を抑えても検出可能であることを意味します(100 倍の感度なら1/100 の分子数でも検出可能)。タグを利用したタンパク質発現実験ではタグの付加による標的タンパク質への影響(アーティファクト) を最小限に抑えるためにより小さいタグを求めて使用していますが、もう一つのアーティファクトの原因、CMV などを利用した過剰発現についてはそ れほど考慮されていないのが実情です。低発現のタンパク質の場合、過剰に発現させて検出レンジに入れなければ実験になりませんが、本来はでき るかぎり内在レベルでの発現が望まれるはずです。HiBiT はこの大きなアーティファクトの問題両方を解決するソリューションなのです。これまでタン パク質を過剰に発現させることでしか見えなかった現象を実際の生体内レベル(内在性レベル)でとらえることができ、本来の生体内の分子数レベル で行われる真の反応が観測できます。実際の例として、ゲノム編集により本来の遺伝子ローカスに発光タグ(HiBiT)を導入することで、過剰発現させ た場合よりも薬剤による応答性が飛躍的に向上しました(次ページ図 1 参照)。これは細胞内のタンパク質と内在性レベルで発現するタグ付加タンパ ク質が適切な化学量論的比率で維持されるからであると推察されます。 “小さくて明るい”これら 2 つの HiBiT の特性は、本来のタンパク質機能にほとんど影響を与えない短いペプチドを簡便に付加し、内在レベルの分子 数でも検出できる感度を獲得できるため、生体内でのありのままのタンパク質のすがたを観察できることにつながります。 過剰発現よさようなら!内在性発現よこんにちは! HiBiT はわずか 11 アミノ酸のタグであることから、CRISPR/Cas9 と非常 に相性が良いテクノロジーと言えます。HiBiT をノックインした後、HiBiT タグ付き内在性タンパク質として検出することで、より生体に近い事象 としてタンパク質発現を観察することができます。 dBET1 は、BRD4 を選択的に分解誘導する PROTAC(Proteolytic Targeting Chimera)のひとつで、E3 ユビキチンリガーゼと BRD4 に結合する二機能 性化合物として知られています。CRISPR/Cas9 を利用して HiBiT- BRD4 を 内在性タンパク質として発現させ、dBET1 の有効性を比較しました。 図 1. A では、CMV、TK 各プロモーターを用いて一過性に発現、あるい は CRISPR/Cas9 を用いて内在性に発現した HiBiT-BRD4 に対する dBET1 の分解誘導を比較しています。強力な CMV プロモーターで駆動するベ クターを多く用いた場合、最も高い HiBiT-BRD4 の発現が確認されまし たが、dBET1 の分解誘導はわずかに観察されるだけでした。一方、弱い TK プロモーターを利用すると発光量は大きく減少するものの、分解誘 導が明確に観察されます。内在性の HiBiT -BRD4 を発現させた場合 発光タグ HiBiT による タンパク質発現解析新時代の幕開け 発光量:ホタルの 約100倍 低親和性 [Kd : 190µM] 高親和性 [Kd : 700pM] 発光量:ホタルの 約30倍 蛍光標識物 ● BRET ドナー – タンパク質間相互作用 – 化合物タンパク質相互作用 – センサー開発 ● ジェネティックレポーター (レポーターアッセイ) ● 細胞内タンパク質アッセイ ● 細胞外タンパク質アッセイ ● 細胞融合、ウイルス感染、 タンパク質の細胞間の伝搬の検出※ ● ブロッティング検出 ● 抗体などの分子標識 ● 修飾基質による酵素アッセイ等 NanoBRET ™ PPI Systems NanoBRET ™ Target Engagement Systems NanoGlo® HiBiT Detection Systems Small BiT (SmBiT) Furimazine (細胞透過性) High BiT (HiBiT) NanoLuc® Dual & Single Assay RealTime-Glo® MT NanoLuc® Technology NanoBiT® Technology Aassay Expression (Fusion or stand alone) Aassay 検出試薬 検出試薬成分※ 11アミノ酸 ※アプリケーションに よっては細胞内発現 により供給 ● タンパク質間相互作用検出 ● タンパク質の多重化/オリゴマー化検出 (PS-Annexin V凝集) ● 融合タンパク質の定量、分解測定、 イメージングなど NanoBiT® PPI System RealTime-Glo® Annexin V System NanoLuc® Luciferase Large BiT (LgBiT) 2 100,000-10,000 RLU のシグナルが得られています。仮に Fluc で同様の アッセイ系が構築できたとしても、2,000-200 RLU 程度の低い発光値し か得られないことが予想されます。すなわち、HiBiT だからこそ初めて 簡便に信頼性の高い内在性発現タンパク質の定量が可能になったので す。一方、LgBiT 安定発現株を用いた図 1B, C では、dBET による HiBiTBRD4 の分解誘導を一過性あるいは内在性の発現で比較しています。驚 くべきことに、dBET1 の分解誘導の効果(EC50)は、一過性発現と比較 し内在性発現では 10 倍以上高く(EC50 として 1/10 以下)現れ、より大 きなアッセイウインドウが得られました。 すなわち、これまで一過性発現系では狭いアッセイウインドウしか得ら れないため、化合物スクリーニングで望ましいリードが得られなかった 標的でも、内在性発現系ではアッセイウインドウが広がり、新たなリー ド化合物が得られる可能性を示唆しています。 受容体のインターナリゼーションを簡便・明瞭に定量化 G タンパク共役型受容体(GPCR)は主に三量体 G タンパク質を介したシ グナル伝達系と、GPCR キナーゼとβアレスチンを介したシグナル伝達系 が知られています。後者伝達経路が前者に遅れて発見されたことに加え て、バイアス型あるいはインバース型アゴニストはこれらの伝達経路へ の作用が通常のアゴニストとは異なることなどから、GPCR 研究分野に おいては両伝達経路を正確に観察することが非常に重要になります。 細胞を溶解しない HiBiT Extracellular Assay により、細胞膜表面上の GPCR のみを検出することが容易になりました。 右上図はβ 2 アドレナリン受容体 ADRB2 の細胞膜上の残存量、すなわ ちインタナリゼーションを観察しています。Isoproterenol(ISO)は EC50 51nM で細胞内取り込み率は 84% を示しました。これと比較して、 Salmeterol(Salm)は、EC50 1nM で細胞内取り込み率 は 37%でした。 Salm の cAMP 産生能(ef cacy)は ISO と同等と報告されています1) が、 受容体インターナリゼーションでは、ISO と異なった ef cacy を示しまし た。すなわち、HiBiT を利用した GPCR のインターナリゼーションアッセ イは、potency のみならず、ef cacy も定量できることを示しています。 受容体インターナリゼーションはβアレスチン経路によるもので、弊社 技術ではタンパク質間相互作用検出システム NanoBRET® (BRET)あるい は NanoBiT® (発光)を用いて検出可能です。これらの検出はβアレスチン の結合を直接観察することができますが、GPCR およびβアレスチンの 両方に酵素やタグを融合させて発現させる必要があるなど若干複雑な 系の構築が必要でした。しかし、HiBiT による受容体インターナリゼー ションは GPCR に HiBiT タグを付加するのみで、そのタグ付位置の許容 範囲(下記)もあり、βアレスチン結合試験よりもはるかに容易になった といえます。上記 ADRB2 における Salm のインターナリゼーショアッセ イの結果は、βアレスチン結合試験の報告と一致しています1) 。HiBiT に よる受容体インターナリゼーションアッセイは、シグナリングにおける アゴニズムの違いを検出する有用なツールになります。もちろん GPCR 以外の膜タンパク質のインターナリゼーションを用いること、さらには 膜への発現・トラフィッキングなどへの応用も期待されます。 タンパク質内部へのタグ挿入も可能 HiBiT が小さいということは、タグ付される元のタンパク質に対しての影 響が非常に小さいことも期待できます。また、タグは N 末端あるいは C 末端に付加することが一般的ですが、N 末端はタンパク機能の必須領域 である場合が多く機能維持による制限があります。 CFTR(Cytic Fibosis Transmembrane Conductance Regulator)は嚢胞性線維 症に関連する塩素チャネルで、508F 欠損変異がその原因であると報告 されています。CFTR の両末端は細胞内にあるため、CFTR の細胞外ルー プに HiBiT を挿入することで、CFTR の細胞膜へのトラフィッキング検出 に成功しています。なお、図 2 においては、ADRB2 のシグナル配列の 直後に HiBiT を挿入しています。このように、HiBiT はタンパク分子内部 に挿入しても、十分に機能し得ることが期待されます。 まとめ HiBiT は 11 アミノ酸という小ささ、LgBiT との高親和性により明るい NanoLuc® 活性を再構成するという特徴から、これまでのアッセイ法で は実施が難しかった細胞内タンパク質の定量観察を可能にし、さまざ まな利用法によりライフサイエンスの大きな前進に寄与することが期待 されます。 200 150 100 50 0 EC50(nM) Endogeneous Cellular Endogeneous Lytic HiBiT-BRD4 Transient Lytic 25 20 15 10 0 5 Assay Window Endogeneous Cellular Endogeneous Lytic HiBiT-BRD4 Transient Lytic 図 .1 PROTAC dBET1 による HiBiT-BRD4 の分解誘導 A:CMV あるいは TK プロモーターを利用して HiBiT-BRD4 を細胞内に一過性にあるいは内 在性発現させ dBET1 の分解誘導を検出した。B, C: LgBiT 安定発現株に HiBiT-BRD4 を CRISPR/Cas9 を用いて内在性に発現させたもの(Live cell format)■、CRISPR/Cas9 を用い て内在性に発現させた HiBiT-BRD4(lytic format)■、一過性に発現させた HiBiT-BRD4 (lytic format)■ をそれぞれの検出試薬で測定した。 図 .2 β 2- adrenagic receptor(ADRB2)のエンドサイトーシス ADRB2 の細胞外ドメインに HiBiT をタグ付けし、アゴニスト刺激 30 分後の細胞外 HiBiT タグを Nano-Glo® HiBiT Extracellular Reagent を用いて検出した。 アゴニスト EC50(nM) 残存 受容体%※ Isoproterenol 50.9 16% Salbutamol 161 45% Salmeterol 1.04 63% Formoterol 2.92 16% ※ 細胞表面に残存する受容体の% 0.5 0.0 0 -10 -9 -8 -7 -6 -5 -4 1.0 1.5 Isoproterenol Salbutamol Salmeterol Formoterol log [Compound] M Normalized RLUs 図 .3 CTFR のエンドサイトーシス A. HiBiT を細胞外ループに挿入した例イメージ(挿入位置を正確に記述したものではあり ません) B. Wild type と F508 欠損を Extracellualr format(細胞表面上の CTFR を反映)お よび Lytic format(細胞全体での CTFR 量を反映)で測定した。 800000 600000 400000 0 200000 RLUs Extracellular Lytic WT F508 A A B B C 参考文献 1)Sudarshan Rajagopal et al. Mol. Pharmacol. 2011, 80, 367 PromegaClubオンサイトセミナー& 寺子屋、全国何処でも駆けつけます! クラブトータル トレーナー (寺子屋塾長) プロメガクラブ(無料)なら様々な特典、サービス で研究のお困りごとを解消します。 新しい HiBiT テクノロジーの詳細、導入に関する ご相談も承ります。 プロメガクラブについての詳細、入会登録は www.promega.co.jp/promegaclub.html 3Promega KAWARABAN
