AACR2024プロメガポスター概要
AACR2024プロメガポスター概要
AACR2024 プロメガポスター概要
<お客様向け情報>
タイトル:#1 CAR T-cell Mediated Cytotoxicity and Cytokine Release in Response to Different Levels of Antigen Expression on Target Cells
概要: 標的細胞上の異なる抗原発現レベルに反応するCAR T細胞を介した細胞傷害性とサイトカイン放出
Lumitイムノアッセイは、サンドイッチELISAやウェスタンブロットを含む従来のイムノアッセイ法に代わる、シンプルで迅速な測定法を提供します。
以下のような点がLumitの利点です。
*洗浄ステップのないシンプルな “添加 – 混合 – 測定” プロトコル
*細胞培養プレートまたは細胞から別プレートに移した培地での直接的な検体測定
*プレート、ビーズ、その他の表面への抗体の固定化は不要
*広いダイナミックレンジを備えた高感度な発光検出
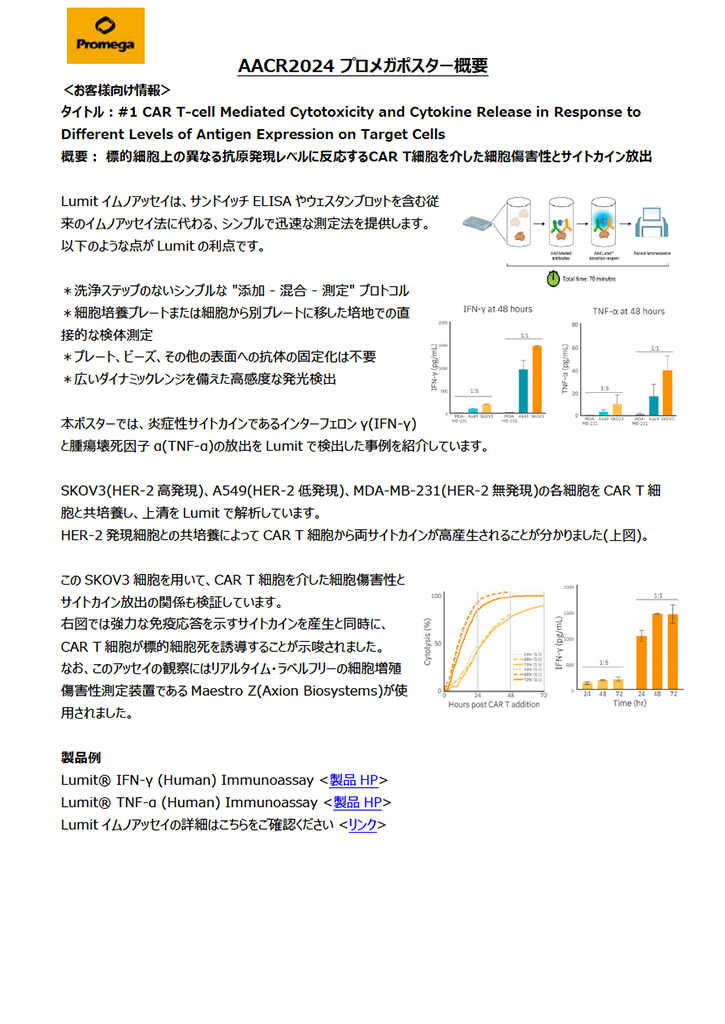
本ポスターでは、炎症性サイトカインであるインターフェロンγ(IFN-γ)と腫瘍壊死因子α(TNF-α)の放出をLumitで検出した事例を紹介しています。
SKOV3(HER-2高発現)、A549(HER-2低発現)、MDA-MB-231(HER-2無発現)の各細胞をCAR T細胞と共培養し、上清をLumitで解析しています。
HER-2発現細胞との共培養によってCAR T細胞から両サイトカインが高産生されることが分かりました(上図)。
このSKOV3細胞を用いて、CAR T細胞を介した細胞傷害性とサイトカイン放出の関係も検証しています。
右図では強力な免疫応答を示すサイトカインを産生と同時に、CAR T細胞が標的細胞死を誘導することが示唆されました。
なお、このアッセイの観察にはリアルタイム・ラベルフリーの細胞増殖傷害性測定装置であるMaestro Z(Axion Biosystems)が使用されました。
製品例
Lumit® IFN-γ (Human) Immunoassay <製品HP>
Lumit® TNF-α (Human) Immunoassay <製品HP>
Lumitイムノアッセイの詳細はこちらをご確認ください <リンク>
AACR2024 プロメガポスター概要
タイトル:#2 Brain permeable bioluminescent substrates for NanoLuc based reporters
概要: 最新基質CFzを用いたマウス脳の生物発光イメージング
生物発光イメージング(BLI)は、生体内の細胞や生化学的事象を非侵襲的に可視化できるため、ライフサイエンスの研究において不可欠な技術です。しかし、脳などの中枢神経系におけるBLIは、既存の基質では脳内でのルシフェラーゼの性能が低いため、困難でした。
プロメガではルシフェラーゼ基質を改良し、脳での生物発光イメージングを改善する新規NanoLuc基質、セファロフリマジン(CFz)を開発しました。
本ポスターでは既存のin vivo用基質FFzと、CFz、並びにレポータータンパク質としてAntaresを活用したBLIアプリケーション事例を示しています。
(Antaresについてはコチラ)
本アッセイのポイント:
・CFzとAntaresルシフェラーゼの組み合わせは、D-ルシフェリンとホタルルシフェラーゼの標準的な組み合わせに比べて、脳での発光イメージングにおいて20倍以上のシグナルを示した(上図)。
・FFzでは優れた溶解度と発光輝度を示したが、脳の他の部位でも発光を示していた。CFzは適切な脳の領域において、顕著な発光を示した(右図)
・CFzを用いて、自由に動くマウスの脳におけるビデオレート発光イメージングを実施できた。
・カルシウムセンサーCaMBIとCFzを用いて、マウスにおけるCaフラックスのリアルタイムイメージングを実施できた。
CFzを用いることで、NanoLucベースのin vivoセンサーによる、高感度な脳イメージングを行うことが可能となります。
参考文献:
Nat Chem Biol. 2023 Jun;19(6):731-739.
An optimized bioluminescent substrate for non-invasive imaging in the brain
AACR2024 プロメガポスター概要
タイトル:#3 Metabolic screening of T cells guides the enrichment of stem cell memory phenotype
概要:高感度発光アッセイによるT細胞の代謝スクリーニング評価
T細胞療法において、T細胞の表現型集団分布、とくにTscm細胞量を正確に予測することは非常に重要です。これらT細胞は分化段階に応じて細胞内代謝機構が異なることが明らかになっています。培養の初期段階で表現型の予測をすることは、製造効率・治療効果の改善を計画できるため、代謝スクリーニングはT細胞の表現型予測における有用なツールの1つです。
プロメガではNAD(P)Hを利用とした発光測定技術を元に、種々の代謝物・栄養因子などを高感度・迅速・簡便に測定する系を構築しました。
本ポスターでは、下記のアプリケーション事例が示されています。
⚫
活性化T細胞の増殖・細胞サイズ・ATP量評価
⚫
活性化T細胞における培地中代謝因子の評価
(右図)
⚫
フローサイトメトリーによるT細胞表現型の評価との相関
プロメガの発光測定法を活用することで、T細胞の代謝状況の
変化・代謝プロファイルを簡便に評価することが可能です。
製品例
細胞エネルギー代謝アッセイのHP<リンク>もしくは、セルベースアッセイガイド<リンク>をご覧下さい。
T細胞増殖アッセイについては、Lumit Ki-67 アッセイもご覧ください。
AACR2024 プロメガポスター概要
A.
B.
タイトル:#4 A Homogeneous Assay System for Discernment of Proliferative, Antiproliferative, and Cytotoxic Effects in Culture
概要: Lumit Immunoassay による細胞増殖・細胞毒性の評価
Ki-67は主要な細胞増殖マーカーとして使用される核タンパク質です。プロメガではLumit Immunoassay技術を応用し、Ki-67を簡単・迅速・高感度に測定可能なアッセイを開発しました。Lumit Immunoassayは洗浄ステップのないシンプルなプロトコルで、短時間(2時間以内)で標的タンパク質を測定できます。発光法のためダイナミックレンジが広く、感度良く検出可能です。また、本アッセイは蛍光ベースの細胞生存・毒性アッセイとのマルチプレックスアッセイを行うことも可能です。本法では、細胞増殖を細胞生存と区別して測定することが可能です。
本ポスターでは、下記のアプリケーション事例が示されています。
⚫
JurkatおよびHeLa細胞におけるKi-67発現評価
⚫
CD8+T細胞の活性化における細胞増殖Ki-67発現の評価 (左下図A)
⚫
Jurkat T細胞におけるPalbocilib(CDK4/6 inhibitor)添加時のKi67発現評価(右下図B)
⚫
Hela細胞におけるBAY-1895344(ATR inhibitor)添加時のKi67発現評価
製品例
Lumit immunoassay 特設ページ <リンク>
AACR2024 プロメガポスター概要
タイトル:#5 Detection and Quantification of Cellular cGAMP using Homogenous HTS Formatted Bioluminescent Assay
概要: HTSフォーマットに対応した、高感度発光アッセイによる細胞内cGAMPの検出と定量化
cyclic GMP-AMP(cGAMP)はサイクリック GMP-AMP 合成酵素 (cGAS) により細胞内で生成されるセカンドメッセンジャーの 1 つです。cGAS が細胞内 DNA を感知すると cGAMP を産生します。cGAMP は細胞内核酸センサー群の 1 つである STING (Stimulator of Interferon Gene) を活性化し、炎症性サイトカインや I 型インターフェロンの産生を強力に誘導し、炎症応答の発生に関与していることが明らかとなっています。
cGAS-cGAMP-STING 経路は、ウイルスなどの外来の微生物に対する防衛策・自然免疫機構として重要視されています。さらに最近では、ウイルス・微生物感染だけでなく、自己免疫疾患やがん、老化、神経変性疾患をはじめとする広範な疾病に関与することが次々と報告されており cGAS-cGAMP-STING 経路は重要な創薬標的となっています。
プロメガでは、細胞内および細胞外におけるcGAMP濃度をモニターする発光アッセイ法を開発しました。この方法は、STING経路を効果的に調節する化合物探索にも適します。
本アッセイ法では、以下のNanoBiTアッセイを応用しています(NanoBiTに関してはこちらをご覧ください)。
サンプル由来のcGAMP非存在時は、LgBiTを結合した抗cGAMP抗体がcGAMPトレーサーを認識し、トレーサーにリンカーを介して結合しているSmBiTと、抗体のLgBiTによるNanoBiT反応が発光シグナルを生じます。サンプルに遊離cGAMPを含む場合、cGAMPトレーサーとの競合が起きるため、量に応じた発光シグナルが減少します。
(右図)
本アッセイのポイント:
・高感度:10 nM以下のcGAMPを検出可能。 10ng以下のcGAS酵素で生じたcGAMPの検出にも適用可能。
・細胞内cGMAPの変動評価が可能: dsDNA刺激を用いたcGASの活性化と、cGASレポーターアッセイの活性化で相関を確認。
・迅速性:1時間未満で測定完了。ホモジニアスアッセイで、HTSに対応。
本アッセイはSTING経路のモジュレーターの研究や新薬探索に有用です。
先行販売品としてご提供が可能です。詳細はプロメガまでお問合せ下さい。
AACR2024 プロメガポスター概要
タイトル:#6 Chemical Proteomic Strategy Utilizing a Photoreactive Chloroalkane Capture Tag for Target Discovery
概要:光反応性クロロアルカン修飾リガンドを用いた標的タンパク質評価アッセイ
候補薬剤における標的タンパク質の同定は、候補薬剤の作用機序を明らかにするために重要です。標的タンパク質の探索には薬剤への修飾が用いられますが、修飾による薬剤の性質への影響性や膜透過性、溶出のしやすさは結果に影響しうる要素となります。
このポスターは、光反応性クロロアルカンならびにHaloTagを用いることにより、効率的かつ非特異的な影響を抑えた標的タンパク質検出のための濃縮法、およびLC-MS解析例を紹介します。また候補ターゲットタンパク質の検証に利用可能な、NanoBRET TEライブセル競合アッセイについて紹介しています。
(上図)
従来使用されるAlkyne-PRGとクロロアルカン-PRGにてレポーターアッセイでの比較を実施。
ほぼ同等の挙動で、修飾の影響が小さいこと示す結果が得られています。
(左下図)
標識化合物の細胞導入、光架橋、HaloTagによる精製・溶出の概略図
HaloTagによる強固な共有結合により、高効率・低バックグラウンドでの化合物結合タンパク質の濃縮が可能です。
(右下図)
蛍光色素(NanoBRET Dye)を標識した候補薬剤と、NanoLuc融合標的タンパク質によるNanoBRET TEアッセイにより、生細胞内での結合評価、競合阻害アッセイが可能です。
光反応性クロロアルカン修飾リガンドを先行販売品としてご提供しております。
詳細は学術課までお問い合わせください。
NanoBRET Dyeについてはこちらをご覧ください
AACR2024 プロメガポスター概要
タイトル:#7 Simple, rapid and robust bioluminescent cell-based assay for detecting
neutralizing antibodies against AAV in serum
概要:AAV-NanoLucを用いた血清中の中和抗体評価アッセイ
アデノ随伴ウイルス(AAV)はがんや希少疾患など、様々な疾患における遺伝子治療において広く活用されています。
しかしながら、AAV中和抗体の個人差によりその効果は変動する為、より簡便な手法にて中和抗体の状況を把握できることが、より良い遺伝子治療において求められます。
このポスターでは、AAV-NanoLucを用いた発光アッセイにより、血清中の中和抗体評価を実施しています。
AAV-NanoLuc・血清・細胞を混ぜてインキュベーションする、簡単なステップで実施が可能です。また、プレートリーダーにて高スループットでの解析に対応します。
左図のAAV9の実例では300~10000 MOIと幅広いアッセイレンジにも対応できることが示されました。
また中和抗体タイターの異なるサンプルに最低限の希釈で対応でき、スクリーニングにも適応した系となっております。
AAV2/8/9でのNanoLuc Viral Particlesや発現用ベクター等は先行販売品にてご提供しています。
詳細ご希望の際はプロメガ学術課へお問い合わせください。
また、プロメガにおけるAAV研究のワークフローについて、下記リンクにてご紹介しております。
併せてご参照ください。
アデノ随伴ウイルス研究 <リンク>
AACR2024 プロメガポスター概要
A.
B.
タイトル:#8 Bioluminescent dehydrogenase assays: A novel approach for metabolic profiling and inhibitor screening in cancer biology
概要: 高感度発光アッセイを用いた、がん研究における代謝プロファイリングと阻害剤スクリーニング評価
デヒドロゲナーゼは細胞代謝において重要な役割を果たします。また、それらの活性は細胞の代謝状態を反映しており、特に、腫瘍における成長や転移、免疫細胞の動態メカニズムを理解する上で非常に重要です。プロメガでは、高感度・迅速・簡便に各種デヒドロゲナーゼ活性を測定できる、発光アッセイを構築しました。
本ポスターでは、下記のアプリケーション事例が示されています。
⚫
384-well plateにおけるハイスループットスクリーニング評価 (図A)
⚫
K562細胞におけるデヒドロゲナーゼ活性評価
⚫
活性化T細胞におけるデヒドロゲナーゼ活性評価 (図B)
製品例
Dehydrogenase-Glo™ Detection System (#J9010)
AACR2024 プロメガポスター概要
タイトル:#9 CD4+ and CD8+ TCRαβ-deficient bioluminescent reporter T cells for screening and characterization of neoantigen-specific TCRs
概要: CD4+およびCD8+ TCRαβ欠損生物発光レポーターT細胞による新抗原特異的TCRのスクリーニングと特性評価
養子T細胞免疫療法の1つであるTCR-T(T cell receptor-engineered T cell)療法は、抗原受容体を導入した遺伝子組み換えT細胞を腫瘍特異的に活性化させ、腫瘍を認識して障害する能力を向上させる、重要ながん治療戦略です。今回プロメガでは組み換えT cell Receptor 評価における従来法の難易度・感度といった課題を克服した、新規のT細胞活性化バイオアッセイ(TCRαβ-KO)を開発しました。
T細胞活性化バイオアッセイ(TCRαβ-KO)は生物発光レポーター細胞ベースのアッセイです。 CRISPR/Cas9を用いて内在性 TCRα 鎖およびβ鎖をノックアウトした遺伝子組み換えJurkat T細胞株を使用します。TCRαβ-KO細胞にTCRαおよびβ鎖を導入すると、細胞表面にトランスジェニックTCRが発現します。この細胞を、抗原提示細胞(例: APCs)で活性化すると、TCR活性化とプロモーターを介した発光が得られます(右図)。
プロメガでは、組み換えTCRを安定的に発現するためのTCR KO
αβ-KO細胞を提供しています。以下のアッセイが可能です。
右図上:インフルエンザヘマグルチニンH3特異的TCR HA1.7を安定発現させたTCRαβ-KO(CD4+)細胞は、HLA-DR+細胞の存在下において、HAペプチドで活性化することが示されました。
右図下: TCRαβ-KO(CD8+)MELAN-A/MART-1特異的TCR DMF5を安定に発現させた細胞は、HLA-A2+細胞の存在下において、MART-1ペプチドで活性化することが示されました。
このように組み換えTCR発現レポーター細胞を作製・評価できるようになったことで、リードTCRを用いた包括的な安全性/交差反応性試験が可能となりました。
製品例
T Cell Activation Bioassay (TCRαβ-KO) <製品HP>
Bio-Glo-NL™ Luciferase Assay System <製品HP>
AACR2024 プロメガポスター概要
タイトル:#10 Development of novel luminescent assays for sensitive and specific quantitation of double-stranded RNA in mRNA therapeutics
概要:mRNA 創薬にさまたげるdsRNA の高感度特異的発光検出法の開発
In vitro transcription により製造するmRNA の活用のための関連研究が盛んとなっています。一方、合成過程で副産物としてはdsRNAが生じることがあります。dsRNAは炎症応答や翻訳阻害、細胞死を誘導する各種の細胞内応答を引き起こすため、最終製品等からの除去等を目的に管理する必要があります。このため、簡便かつ定量性のよいdsRNAの検出法に注目が集まっています。
プロメガでは、NanoBiT テクノロジーを利用したdsRNA 検出系を開発しました。洗浄の要らない測定法で、感度、特異性にすぐれたアッセイとなっています。
プロメガ特有のNanoBiT/Lumit テクノロジーを用いた本アッセイでは、dsRNA 結合タンパク質がdsRNA存在下で近接することにより、ルシフェラーゼが再構成され発光します。この方法で、60-8,000 bp といった幅広いdsRNA の定量に利用可能であることが示されています(右図)。ポスター表外では>30 bp についても検証しています。
またdsRNA については、細胞に対する影響という観点からも評価する必要があります。
TLR3 Bioassay ではTLR3とその下流で活性化するNanoLucレポーターを利用しています。dsRNAで刺激後、TLR3を介して細胞におきた応答反応を検出します(右下図)。
dsRNA による応答の違いが検出可能です。
これらのアッセイは 現在先行販売品でのご提供となります。
ご興味の際は、お問い合わせください。
関連製品
Lumit dsRNA Detection Assay (特注品)
TLR3 Bioassay (特注品、使い切りタイプ、細胞株タイプ)
RiboMAX シリーズ製品(Promega #P1320, P1300など)
ReliaPrep RNA Clean-up 製品 (Z1071など)
AACR2024 プロメガポスター概要
タイトル:#11 A NanoBRET Target Engagement Assay for querying domain selectivity at full-length Polymerase Theta in live cells
概要:NanoBRETターゲットエンゲージメントアッセイを利用した、生細胞内の全長ポリメラーゼシータにおけるドメイン選択性の解析
NanoBRET™ Target Engagement Assayは、NanoLuc® ルシフェラーゼと蛍光性NanoBRET™トレーサーの近接による、生物発光共鳴エネルギー移動(BRET)を利用するアッセイです。生細胞における標的タンパク質と小分子との結合を、発光測定で検出します(下図)。
本ポスターでは、ポリメラーゼとヘリカーゼの両ドメインを有するポリメラーゼθをターゲットにした、新たなNanoBRET™ Assayを提示しています。
ポリメラーゼドメインに特異的に結合するプローブとDNA断片を生細胞に導入する手法により、シグナルが増強されました(右図)。
NanoBRETアッセイの結果はTMEJアッセイと相関することが確認されました(下図左)。
またヘリカーゼドメインに特異的に結合するプローブも開発されました(下図右)。
これらを組み合わせることで、生細胞内のポリメラーゼθの作用メカニズムの詳細な解析が可能となります。
製品例
NanoBRET® 590 Dyes <リンク>
NanoBRET™ Target Engagement Assayの詳細は、こちらをご確認ください。<リンク>
AACR2024 プロメガポスター概要
タイトル:#12 A live cell PRMT5 NanoBRET™ Target Engagement Assay querying competitive and uncompetitive modes of inhibition
概要:NanoBRET™ Target Engagement Assayを用いた生細胞の選択的薬剤結合評価アッセイ
NanoBRET™ Target Engagement Assayでは、標的タンパク質の結合ポケットに対応する細胞透過性蛍光プローブを用いることにより、生細胞内にて標的箇所結合薬剤との競合評価を行うことが可能です。
このポスターでは、PRMT5を対象に酵素・補酵素それぞれの活性ポケットへ反応する蛍光プローブを用いて、各薬剤における競合評価を行っています。
下図は、正常細胞とMTAP(-)細胞にて、補酵素MTA結合のPRMT5特異的に結合する非競合的阻害薬であるMRTX1719を用いて、細胞内PRMT5補酵素結合状態における差を評価しています。
<詳細情報>
NanoBRET™ Target Engagement Assay詳細 <リンク>
検証済みターゲットタンパク質リスト <リンク>
AACR2024 プロメガポスター概要
タイトル:#13 Exploring the Landscape of PARP and PARG Inhibitor Selectivity in
Live Cells Using NanoBRET™ Target Engagement Assays
概要:NanoBRET™ を利用したPARP/PARG 阻害剤選択性の探索方法
PARPファミリータンパク質は細胞応答の様々なプロセスに関与し、近年では合成致死のターゲットとしても注目されています。またPoly(ADP-ribose) Glycohydrolase (PARG) によるリサイクル機構も知られており、こちらも創薬ターゲットとなっています(右図)。
NanoBRET™ Target Engagement技術および新規Pan-PARP Tracerを用いることで、細胞内でこれらタンパク質の阻害剤探索を行うことが可能となりました。これまで難しかった、どのPARPに対する阻害効果が見られるか、といった比較検証例も紹介しています。
PARG は専用のNanoBRET™ PARG tracer を開発し、アッセイ例として紹介しております。
ハイスループットに対応したアッセイシステムも開発しています。Pan-PARPについてはトランスフェクションを用いるセット品とともに、トランスフェクションした使い切りHEK293細胞製品もございます。
上記の製品は先行販売品となります。ご興味がございましたら、お問い合わせください。
関連製品
TransfectionNOW™ HEK293 Cell, #NC1001/NC1002
NanoBRET™ TE PARP Kit #1 (先行販売品)
各PARPアッセイ用NanoLuc 融合ベクター(先行販売品)
使い切りThaw-and-Use細胞(先行販売品)
AACR2024 プロメガポスター概要
タイトル:#14 Novel Cell-Based Bioassays Enable Preclinical Animal Studies During
Immuno-oncology Drug Development
概要:免疫腫瘍薬開発における前臨床動物試験を可能とする新規の細胞ベース・バイオアッセイ
ヒトおよび動物のがん免疫療法薬(Immuno-oncology Drug)の開発には動物モデル(マウス、サル、イヌ)が用い
られています。これらの前臨床試験においては、有効な非ヒト抗体や交差反応性抗体が不可欠です。
本ポスターではヒトと動物の健康のための医薬品開発に使用するモノクローナル抗体を検証するための、新たな細胞
ベースのバイオアッセイツールを2 つ紹介します。
