GloMax プレートリーダーでちょい足しデュアルルシフェラーゼアッセイ (タンパク質レベル、転写活性 & 細胞生存性試験のマルチアッセイ)
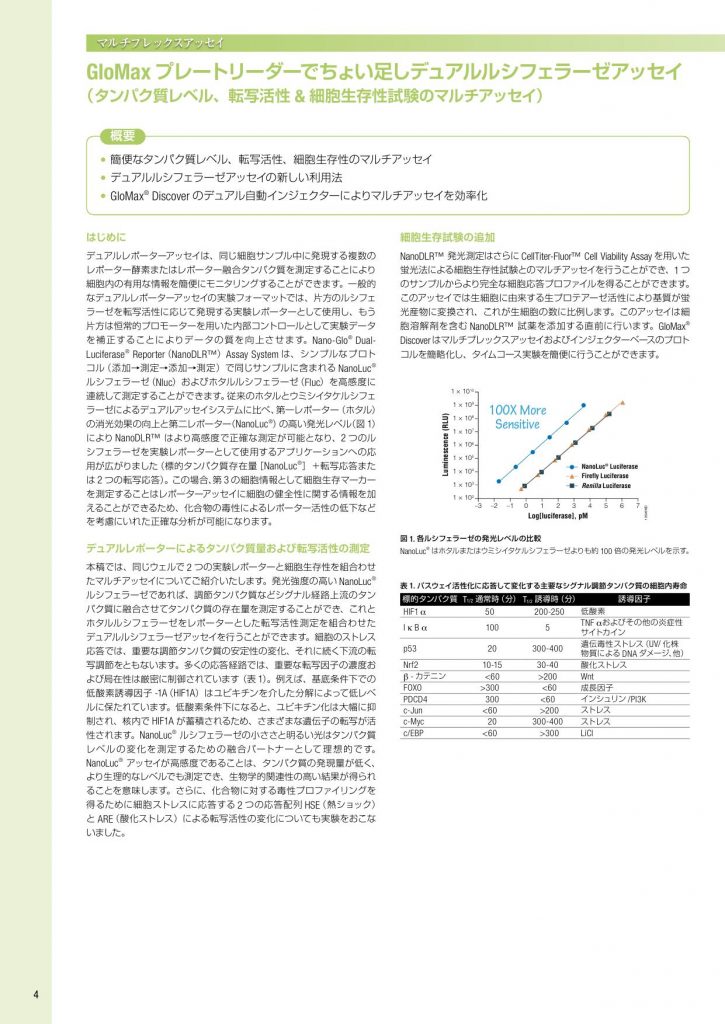
はじめに デュアルレポーターアッセイは、同じ細胞サンプル中に発現する複数の レポーター酵素またはレポーター融合タンパク質を測定することにより 細胞内の有用な情報を簡便にモニタリングすることができます。一般的 なデュアルレポーターアッセイの実験フォーマットでは、片方のルシフェ ラーゼを転写活性に応じて発現する実験レポーターとして使用し、もう 片方は恒常的プロモーターを用いた内部コントロールとして実験データ を補正することによりデータの質を向上させます。Nano-Glo® DualLuciferase® Reporter(NanoDLR™)Assay System は、シンプルなプロト コル(添加→測定→添加→測定)で同じサンプルに含まれる NanoLuc® ルシフェラーゼ(Nluc)およびホタルルシフェラーゼ(Fluc)を高感度に 連続して測定することができます。従来のホタルとウミシイタケルシフェ ラーゼによるデュアルアッセイシステムに比べ、第一レポーター(ホタル) の消光効果の向上と第二レポーター(NanoLuc® )の高い発光レベル(図 1) により NanoDLR™ はより高感度で正確な測定が可能となり、2 つのル シフェラーゼを実験レポーターとして使用するアプリケーションへの応 用が広がりました(標的タンパク質存在量[NanoLuc®]+転写応答また は 2 つの転写応答)。この場合、第 3 の細胞情報として細胞生存マーカー を測定することはレポーターアッセイに細胞の健全性に関する情報を加 えることができるため、化合物の毒性によるレポーター活性の低下など を考慮にいれた正確な分析が可能になります。 デュアルレポーターによるタンパク質量および転写活性の測定 本稿では、同じウェルで 2 つの実験レポーターと細胞生存性を組合わせ たマルチアッセイについてご紹介いたします。発光強度の高い NanoLuc® ルシフェラーゼであれば、調節タンパク質などシグナル経路上流のタン パク質に融合させてタンパク質の存在量を測定することができ、これと ホタルルシフェラーゼをレポーターとした転写活性測定を組合わせた デュアルルシフェラーゼアッセイを行うことができます。細胞のストレス 応答では、重要な調節タンパク質の安定性の変化、それに続く下流の転 写調節をともないます。多くの応答経路では、重要な転写因子の濃度お よび局在性は厳密に制御されています(表 1)。例えば、基底条件下での 低酸素誘導因子 -1A(HIF1A)はユビキチンを介した分解によって低レベ ルに保たれています。低酸素条件下になると、ユビキチン化は大幅に抑 制され、核内で HIF1A が蓄積されるため、さまざまな遺伝子の転写が活 性されます。NanoLuc® ルシフェラーゼの小ささと明るい光はタンパク質 レベルの変化を測定するための融合パートナーとして理想的です。 NanoLuc® アッセイが高感度であることは、タンパク質の発現量が低く、 より生理的なレベルでも測定でき、生物学的関連性の高い結果が得られ ることを意味します。さらに、化合物に対する毒性プロファイリングを 得るために細胞ストレスに応答する 2 つの応答配列 HSE(熱ショック) と ARE(酸化ストレス)による転写活性の変化についても実験をおこな いました。 細胞生存試験の追加 NanoDLR™ 発光測定はさらに CellTiter-Fluor™ Cell Viability Assay を用いた 蛍光法による細胞生存性試験とのマルチアッセイを行うことができ、1 つ のサンプルからより完全な細胞応答プロファイルを得ることができます。 このアッセイでは生細胞に由来する生プロテアーゼ活性により基質が蛍 光産物に変換され、これが生細胞の数に比例します。このアッセイは細 胞溶解剤を含む NanoDLR™ 試薬を添加する直前に行います。GloMax® Discoverはマルチプレックスアッセイおよびインジェクターベースのプロト コルを簡略化し、タイムコース実験を簡便に行うことができます。 マルチプレックスアッセイ GloMax プレートリーダーでちょい足しデュアルルシフェラーゼアッセイ (タンパク質レベル、転写活性 & 細胞生存性試験のマルチアッセイ) 概要 • 簡便なタンパク質レベル、転写活性、細胞生存性のマルチアッセイ • デュアルルシフェラーゼアッセイの新しい利用法 • GloMax® Discover のデュアル自動インジェクターによりマルチアッセイを効率化 図 1. 各ルシフェラーゼの発光レベルの比較 NanoLuc® はホタルまたはウミシイタケルシフェラーゼよりも約 100 倍の発光レベルを示す。 Log[luciferase], pM 10549MD Luminescence (RLU) –3 –2 –1 0 1 2 3 4 5 6 7 1 × 102 1 × 103 1 × 104 1 × 105 1 × 106 1 × 107 1 × 108 1 × 109 1 × 1010 Firefly Luciferase Renilla Luciferase NanoLuc® Luciferase 100X More Sensitive 表 1. パスウェイ活性化に応答して変化する主要なシグナル調節タンパク質の細胞内寿命 標的タンパク質 T1/2 通常時(分) T1/2 誘導時(分) 誘導因子 HIF1 α 50 200-250 低酸素 I κ B α 100 5 TNF αおよびその他の炎症性 サイトカイン p53 20 300-400 遺伝毒性ストレス(UV/ 化株 物質による DNA ダメージ、他) Nrf2 10-15 30-40 酸化ストレス β – カテニン <60 >200 Wnt FOXO >300 <60 成長因子 PDCD4 300 <60 インシュリン /PI3K c-Jun <60 >200 ストレス c-Myc 20 300-400 ストレス c/EBP <60 >300 LiCl 4 結論 ストレス応答経路の多くの転写因子は分解によりその活性が制御され ており、下流の転写活性とともに同じシグナル経路上のパスウェイポイン トを調べることは生物学的理解を深めます。また、化合物による毒性 プロファイリングを調べるために 2 種類のストレス応答を分析すること は化合物の毒性スクリーニングなどに有用です。Nano-Glo® Dual Luciferase Reporter(NanoDLR™)Assay を使用して、NanoLuc® 融合タンパク質に よるタンパク質蓄積と、luc2Pレポーター遺伝子上流の制御プロモーター 上の転写因子活性の組合わせまたは 2 種類の制御プロモーターを用い たデュアルシフェラーゼアッセイを行いました。フェナントロリン処理 後のタイムコース実験では、HIF1A 転写因子の蓄積と下流の転写活性化 との間にタイムラグが生じていることが示されました。また、tBHQ 添加 によるストレス分析ではヒートショック(HSE)および抗酸化(ARE)応 答配列を強く活性化しました。 さらに、NanoDLR™ で両方のレポーターを実験レポーターとして使用す る場合に、テスト化合物によって引き起こされる毒性モニタリングに細 胞生存性試験を追加することは有用で、発光アッセイと CellTiter-Fluor™ Assay の蛍光アッセイをマルチプレックス化することで実現できます。 GloMax® のデュアルインジェクターを使用することで、試薬の追加と測 定を自動化できます。図 2 のように化合物の用量反応をアッセイする場 合、タイムポイントごとにインキュベーターからプレートを取り出してル ミノメーターにセットする、といったアッセイフォーマットを飛躍的に単 純化できます。2 つの実験レポーターと細胞生存性を組合わせたマルチ プレックスアッセイは 1 つのサンプルより得られる情報量を飛躍的に増 加させます(図 3)。 製品名 サイズ カタログ 番号 価格(¥) 特別価格 * (¥) デュアルアッセイ試薬 + コントロールベクター Nano-Glo® Dual-Luciferase®/pNL 1.1.TK Bundle 1 セット N1521 80,000 56,000 Nano-Glo® Dual-Luciferase®/pNL1.1 PGK Bundl 1 セット N1531 80,000 56,000 Nano-Glo® Dual-Luciferase®/pGL4.54 luc2/TK 1 セット N1541 80,000 56,000 Nano-Glo® Dual-Luciferase®/pGL4.53 [luc2/PGK] Bundle 1 セット N1551 80,000 56,000 デュアルアッセイ試薬 Nano-Glo® Dual-Luciferase® Reporter Assay 10 ml N1610 40,000 28,000 細胞生存試験 CellTiter-Fluor™ Cell Viability Assay 10 ml G6080 17,500 12,250 トランスフェクション FuGENE® HD Transfection Reagent 1 ml E2311 65,000 45,500 ViaFect™ Transfection Reagent 0.75 ml E4981 60,000 42,000 レポーターベクター pGL4.42[luc2P/HRE/Hygro]Vector 20 µg E4001 73,000 51,100 pNLF1-HIF1a[CMV/neo] Vector System 20 µg N1381 73,000 51,100 pGL4.41[luc2P/HSE/Hygro]Vector 20 µg E3751 73,000 51,100 *2019 年 8 月 23 日受注分まで 図 2. HEK293 細胞のフェナントロリンによる処理後の用量反応とタイムコース パネル A:単一の時点における用量反応では、フェナントロリン濃度依存的な HIF1A-Nluc 融合タンパク質の蓄積およびレポーター遺伝子 luc2P によって測定される低酸素応答の 活性化が示された。パネルB:100 μMフェナントロリンの添加後の経時的なレポーター 測定値を未処理細胞と比較した発光の倍率変化としてプロットした。タイムコース実験 では、HIF1A の蓄積とそれに続く核内転写活性化との間に生じる遅れが明示されていま した。パネル C:細胞を CellTiter-Fluor™ 試薬とともにインキュベートし、NanoDLR™ アッ セイを行う前に蛍光を測定することにより、NanoDLR™ に細胞生存率測定を追加したマ ルチプレックスアッセイ実施した。この時点での CellTiter-Fluor™ 測定では高濃度のフェ ナントロリンで若干の毒性を示した。エラーバーは 6 回反復実験の SEM を表す。 13950MA Log10 [Phenanthroline] (M) HRE-luc2P HIF1A-Nluc HRE-luc2P HIF1A-Nluc CellTiter-Fluor HRE-luc2P HIF1A-Nluc A.RLU –7 –6 –5 –4 1,000,000 100,000 10,000 Log10 [Phenanthroline] (M) C. –7 –6 –5 –4 10 1 Time (hours) B. Fold Response Fold Response (log scale) 0 2 4 6 8 15 10 0 5 図 3. 同一サンプルより得られた細胞生存性、抗酸化応答性(ARE)および熱ショック 応答性(HSE)の測定 HepG2 に pNL[NlucP/ARE/Hygro]および pGL4.41[luc2P/HSE]をトランスフェクションし、 tBHQ で処理した。O/N インキュベーションした後、CellTiter-Fluor™ Cell Viability Assayで 細胞生存性を測定した後、さらに HSE および ARE 応答性を NanoDLR™ Assayで測定した。 ・レポーターアッセイってなになになーに ? ・ トランスフェクションってなになになーに ? ・ 細胞認証ってなになになーに ? ・ 細胞生存性アッセイってなになになーに ? ・ NanoLuc ってなになになーに ? 最新号 ルミノメーターってなになになーに ? mRNA AUCGAUCG mRNA AUCGAUCG と 遺伝子はプロモーターやシグナル応答配列などの「転写調節領域」によって転写量が調節されているよ。 転写量の調節を測定することは、外からの刺激に細胞がどう反応するか調べることにもなるよ。 レポーターアッセイは、これを簡単に正確に測定できる優れた方法だよ。 こんにちは、ほたるんさんエビビンさん。 先日、指導教官から、 遺伝子 Xのプロモーター活性を、 レポーターアッセイで調べなさい、 と言われました。 レポーターアッセイって何ですか? X X X タンパク質 ふやす or へらす タンパク質 ルシ ルシ ルシ ふやす or へらす ● 数分~10 分くらいで測れるよ! ● すっごく感度が良くて、しかも簡単だよ! ● 同じやり方で、どんな種類の 転写調節領域の活性も 調べることができるよ! ルシフェラーゼが出す光を 測定するよ! ルシフェラーゼアッセイ ● 簡単な準備で様々な遺伝子 の mRNA を定量できるよ ● でも塩基配列の違いで定量 結果に差や偏りが出ること があるよ mRNA 量を測るよ! 定量 PCR なになになーに? ほたるん エビビン プロ メガ子より ● トランスフェクションしなく ていいよ ● でも検出感度は抗体の性能 によって変わってしまうよ タンパク質を測るよ! ウエスタンブロッティング レポーターアッセイって ルシフェラーゼは 光を発生する タンパク質だよ 遺伝子の産物の量を測れば 転写活性がわかるけど… レポーターアッセイは遺伝子 X のかわりに、 測定が簡単なルシフェラーゼの遺伝子を使うんだよ! Q A 転写調節領域 遺伝子 X 転写調節領域 ルシフェラーゼ遺伝子 NEXT PAGE だけど 準備が必要だよ! 遺伝子の発現がどれくらい活発かを、数値化する方法だよ! プロメガ株式会社 レポーター実験を始めたい方は “なになになーに”が超おすすめ! www.promega.co.jp/naninani/ 上記以外のルシフェラーゼ レポーターベクターについては こちらの選択ガイドを ご覧ください。 と なになになーに? ほたるん エビビン ルミノメーターって Vol.6 こんにちは、ほたるんさんエビビンさん。 うちの先生がついに 96/384ウェルプレート対応のプレート リーダーを買うことに! ひゃっほーい! 最強最高のルミノメーターを選ぶよう 言われたので、選び方のコツを教えてください。 Q プロ メガ子より 機器選びってワクワクするよね! ルミノメーターにもいろんな機種があって迷っちゃうけど、 この 2 点を押さえれば失敗しないよ! あと、シンプルで誰でも使いこなせることも大事だね! A ダイナミックレンジとクロストークに注目しよう! ダイナミックレンジとは クロストークとは 検出できる最も弱い発光と最も強い発光の差の幅のこ とだよ! ダイナミックレンジが広いとシグナルの強さが バラバラのサンプルでも同じプレートで測定できるよ! ダイナミックレンジ 広いとき … 設定を変えずにそのまま測定できる 狭いとき … 強く光るサンプルはサチるし、弱い発光は検出でき ないね。サンプル濃度を調整してやり直しだよ… 発光アッセイしたときに、強く光るウェルから周りの ウェルに光が漏れ込んでしまうことだよ! まわりの ウェルからの光をシャットアウトするしくみは正確な測 定に絶対必要だよ! 実験を機器の検出限界に合わせ ないで済めば、時間やサンプル、 試薬の節約になるんだ! この 2 つのハードルを 軽やかにクリアした 最優秀機種とは!? すごく 光るサンプル 隣のウェル から漏れこむ光 マルチウェルプレート断面図 水 サンプル 検出器 わずかに 光るサンプル ただの水から 発光値!? プロメガ株式会社 5Promega KWA RBAN
