in vitro ? in vivo ? それともプロメガの発光 3Dアッセイ?
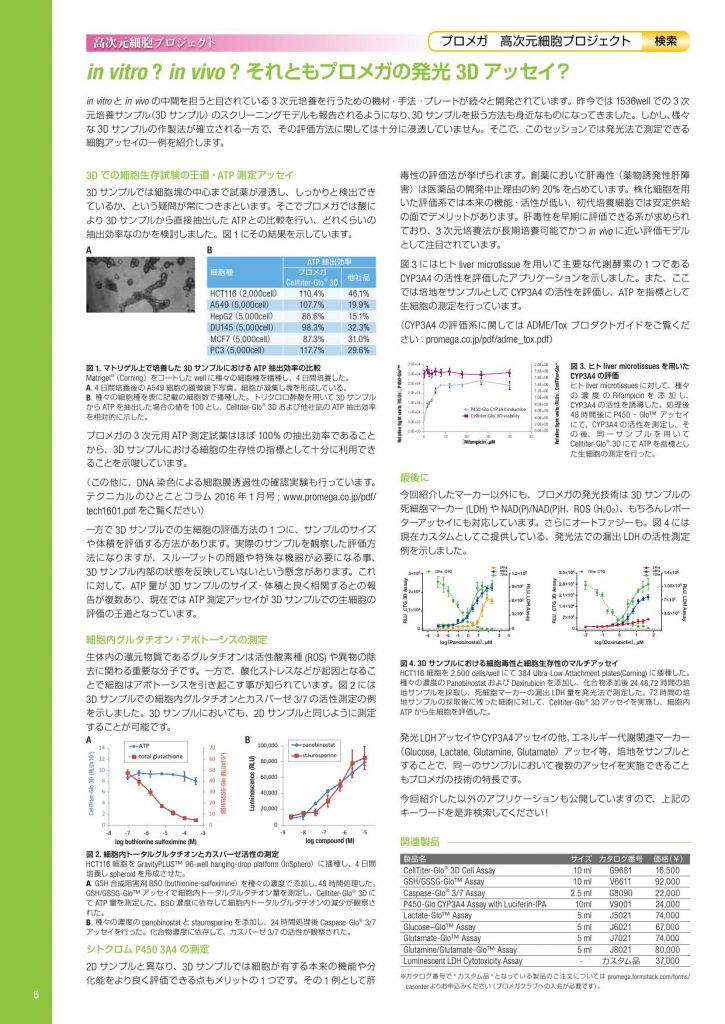
in vitro ? in vivo ? それともプロメガの発光 3D アッセイ? 高次元細胞プロジェクト 3D での細胞生存試験の王道・ATP 測定アッセイ 3D サンプルでは細胞塊の中心まで試薬が浸透し、しっかりと検出でき ているか、という疑問が常につきまといます。そこでプロメガでは酸に より 3D サンプルから直接抽出した ATP との比較を行い、どれくらいの 抽出効率なのかを検討しました。図 1 にその結果を示しています。 プロメガの 3 次元用 ATP 測定試薬はほぼ 100% の抽出効率であること から、3D サンプルにおける細胞の生存性の指標として十分に利用でき ることを示唆しています。 (この他に、DNA 染色による細胞膜透過性の確認実験も行っています。 テクニカルのひとことコラム 2016 年 1 月号 ; www.promega.co.jp/pdf/ tech1601.pdf をご覧ください) 一方で 3D サンプルでの生細胞の評価方法の 1 つに、サンプルのサイズ や体積を評価する方法があります。実際のサンプルを観察した評価方 法になりますが、スループットの問題や特殊な機器が必要になる事、 3D サンプル内部の状態を反映していないという懸念があります。これ に対して、ATP 量が 3D サンプルのサイズ・体積と良く相関するとの報 告が複数あり、現在では ATP 測定アッセイが 3D サンプルでの生細胞の 評価の王道となっています。 細胞内グルタチオン・アポトーシスの測定 生体内の還元物質であるグルタチオンは活性酸素種 (ROS) や異物の除 去に関わる重要な分子です。一方で、酸化ストレスなどが起因となるこ とで細胞はアポトーシスを引き起こす事が知られています。図 2 には 3D サンプルでの細胞内グルタチオンとカスパーゼ 3/7 の活性測定の例 を示しました。3D サンプルにおいても、2D サンプルと同じように測定 することが可能です。 シトクロム P450 3A4 の測定 2D サンプルと異なり、3D サンプルでは細胞が有する本来の機能や分 化能をより良く評価できる点もメリットの 1 つです。その 1 例として肝 毒性の評価法が挙げられます。創薬において肝毒性(薬物誘発性肝障 害)は医薬品の開発中止理由の約 20% を占めています。株化細胞を用 いた評価系では本来の機能・活性が低い、初代培養細胞では安定供給 の面でデメリットがあります。肝毒性を早期に評価できる系が求められ ており、3 次元培養法が長期培養可能でかつ in vivo に近い評価モデル として注目されています。 図 3 にはヒト liver microtissue を用いて主要な代謝酵素の 1 つである CYP3A4 の活性を評価したアプリケーションを示しました。また、ここ では培地をサンプルとして CYP3A4 の活性を評価し、ATP を指標として 生細胞の測定を行っています。 (CYP3A4 の評価系に関しては ADME/Tox プロダクトガイドをご覧くだ さい:promega.co.jp/pdf/adme_tox.pdf) 最後に 今回紹介したマーカー以外にも、プロメガの発光技術は 3D サンプルの 死細胞マーカー (LDH) や NAD(P)/NAD(P)H、ROS(H2O2)、もちろんレポー ターアッセイにも対応しています。さらにオートファジーも。図 4 には 現在カスタムとしてご提供している、発光法での漏出 LDH の活性測定 例を示しました。 発光LDHアッセイやCYP3A4アッセイの他、エネルギー代謝関連マーカー (Glucose, Lactate, Glutamine, Glutamate)アッセイ等、培地をサンプルと することで、同一のサンプルにおいて複数のアッセイを実施できること もプロメガの技術の特長です。 今回紹介した以外のアプリケーションも公開していますので、上記の キーワードを是非検索してください! プロメガ 高次元細胞プロジェクト 検索 in vitro と in vivo の中間を担うと目されている 3 次元培養を行うための機材・手法・プレートが続々と開発されています。昨今では 1536well での 3 次 元培養サンプル(3D サンプル)のスクリーニングモデルも報告されるようになり、3D サンプルを扱う方法も身近なものになってきました。しかし、様々 な 3D サンプルの作製法が確立される一方で、その評価方法に関しては十分に浸透していません。そこで、このセッションでは発光法で測定できる 細胞アッセイの一例を紹介します。 図 1. マトリゲル上で培養した 3D サンプルにおける ATP 抽出効率の比較 Matrigel® (Corning)をコートした well に種々の細胞種を播種し、4 日間培養した。 A. 4 日間培養後の A549 細胞の顕微鏡下写真。細胞が凝集し塊を形成している。 B. 種々の細胞種を表に記載の細胞数で播種した。トリクロロ酢酸を用いて 3D サンプル から ATP を抽出した場合の値を 100 とし、Celltiter-Glo® 3D および他社品の ATP 抽出効率 を相対的に示した。 A 図 2. 細胞内トータルグルタチオンとカスパーゼ活性の測定 HCT116 細胞を GravityPLUS™ 96-well hanging-drop platform(InSphero)に播種し、4 日間 培養し spheroid を形成させた。 A. GSH 合成阻害剤 BSO(buthionine-sulfoximine)を種々の濃度で添加し、48 時間処理した。 GSH/GSSG-Glo™ アッセイで細胞内トータルグルタチオン量を測定し、Celltiter-Glo® 3D に て ATP 量を測定した。BSO 濃度に依存して細胞内トータルグルタチオンの減少が観察さ れた。 B. 種々の濃度の panobinostat と staurosporine を添加し、24 時間処理後 Caspase-Glo® 3/7 アッセイを行った。化合物濃度に依存して、カスパーゼ 3/7 の活性が観察された。 図 3. ヒト liver microtissues を用いた CYP3A4 の評価 ヒト liver microtissues に対して、種々 の濃度の Rifampicin を 添 加 し、 CYP3A4 の活性を誘導した。処理後 48 時間後に P450‐Glo™ アッセイ にて、CYP3A4 の活性を測定し、そ の 後、 同 一 サ ン プ ル を 用 い て Celltiter-Glo® 3D にて ATP を指標とし た生細胞の測定を行った。 図 4. 3D サンプルにおける細胞毒性と細胞生存性のマルチアッセイ HCT116 細胞を 2,500 cells/well にて 384 Ultra-Low Attachment plates(Corning) に播種した。 種々の濃度の Panobinostat および Dexirubicin を添加し、化合物添加後 24,48,72 時間の培 地サンプルを採取し、死細胞マーカーの漏出 LDH 量を発光法で測定した。72 時間の培 地サンプルの採取後に残った細胞に対して、Celltiter-Glo® 3D アッセイを実施し、細胞内 ATP から生細胞を評価した。 3×104 72hs_CTG 24hs 48hs 72hs RLU_CTG 3D Assay RLU_LDH Assay log[Panobinostat], µM 2×104 1×104 1.2×106 9×105 6×105 3×105 0 0 -4 -3 -5 -1 0 1 3 4 3.5×104 RLU_CTG 3D Assay RLU_LDH Assay log[Doxirubictin], µM 2.8×104 2.1×104 1.4×104 7×103 1.4×106 1.05×106 7×105 3.5×105 0 -2 -1 0 1 2 72hs_CTG 24hs 48hs 72hs B 細胞種 ATP 抽出効率 プロメガ Celltiter-Glo® 3D 他社品 HCT116(2,000cell) 110.4% 46.1% A549(5,000cell) 107.7% 19.9% HepG2(5,000cell) 86.6% 15.1% DU145(5,000cell) 98.3% 32.3% MCF7(5,000cell) 87.3% 31.0% PC3(5,000cell) 117.7% 29.6% 0 20,000 40,000 60,000 80,000 100,000 -9 -8 -7 -6 -5 Luminescence (RLU) log compound (M) panobinostat staurosporine 0 10 20 30 40 50 60 70 0 2 4 6 8 10 12 14 -8 -7 -6 -5 -4 -3 GSH/GSSG-Glo (RLUx104 ) CellTiter-Glo 3D (RLUx104 ) log buthionine sulfoximine (M) ATP total glutathione A B 関連製品 製品名 サイズ カタログ番号 価格(¥) CellTiter-Glo® 3D Cell Assay 10 ml G9681 16,500 GSH/GSSG-Glo™ Assay 10 ml V6611 92,000 Caspase-Glo® 3/7 Assay 2.5 ml G8090 22,000 P450-Glo CYP3A4 Assay with Luciferin-IPA 10ml V9001 24,000 Lactate-Glo™ Assay 5 ml J5021 74,000 Glucose–Glo™ Assay 5 ml J6021 67,000 Glutamate-Glo™ Assay 5 ml J7021 74,000 Glutamine/Glutamate-Glo™ Assay 5 ml J8021 80,000 Luminescent LDH Cytotoxicity Assay – カスタム品 37,000 ※カタログ番号で ” カスタム品 ” となっている製品のご注文については promega.formstack.com/forms/ casorder よりお申込みください(プロメガクラブへの入会が必要です)。 3.5E+04 2.0E+06 1.8E+06 1.6E+06 1.4E+06 1.2E+06 1.0E+06 8.0E+05 6.0E+05 4.0E+05 2.0E+05 0.0E+00 3.0E+04 2.5E+04 2.0E+04 1.5E+04 1.0E+04 5.0E+03 0.0E+00 0 10 20 30 40 50 Relative light units(RLUs), CellTiter-Glo® Relative light units(RLUs), P450-Glo™ [Rifampicin],µM P450-Glo CYP3A4 induction Celltiter-Glo® 3D-viability 6
